What confirmations and verifications should filter manufacturers conduct?
除菌过滤作为一种风险较高的灭菌方式,在进行质量管理时应当从源头开始把控风险。
而除菌过滤器的源头风险控制则是对生产商提出了质量要求。
过滤器生产商通常应当按照适当的药典方法对过滤器进行确认并公开结果,使其适用于药物生产。该确认文件可以作为用户工艺验证的一部分,但不能替代工艺验证。PDA 26号技术报告详细列出了生产商及用户应当分别对过滤膜和过滤装置进行的相应确认和验证工作。
确认及验证建议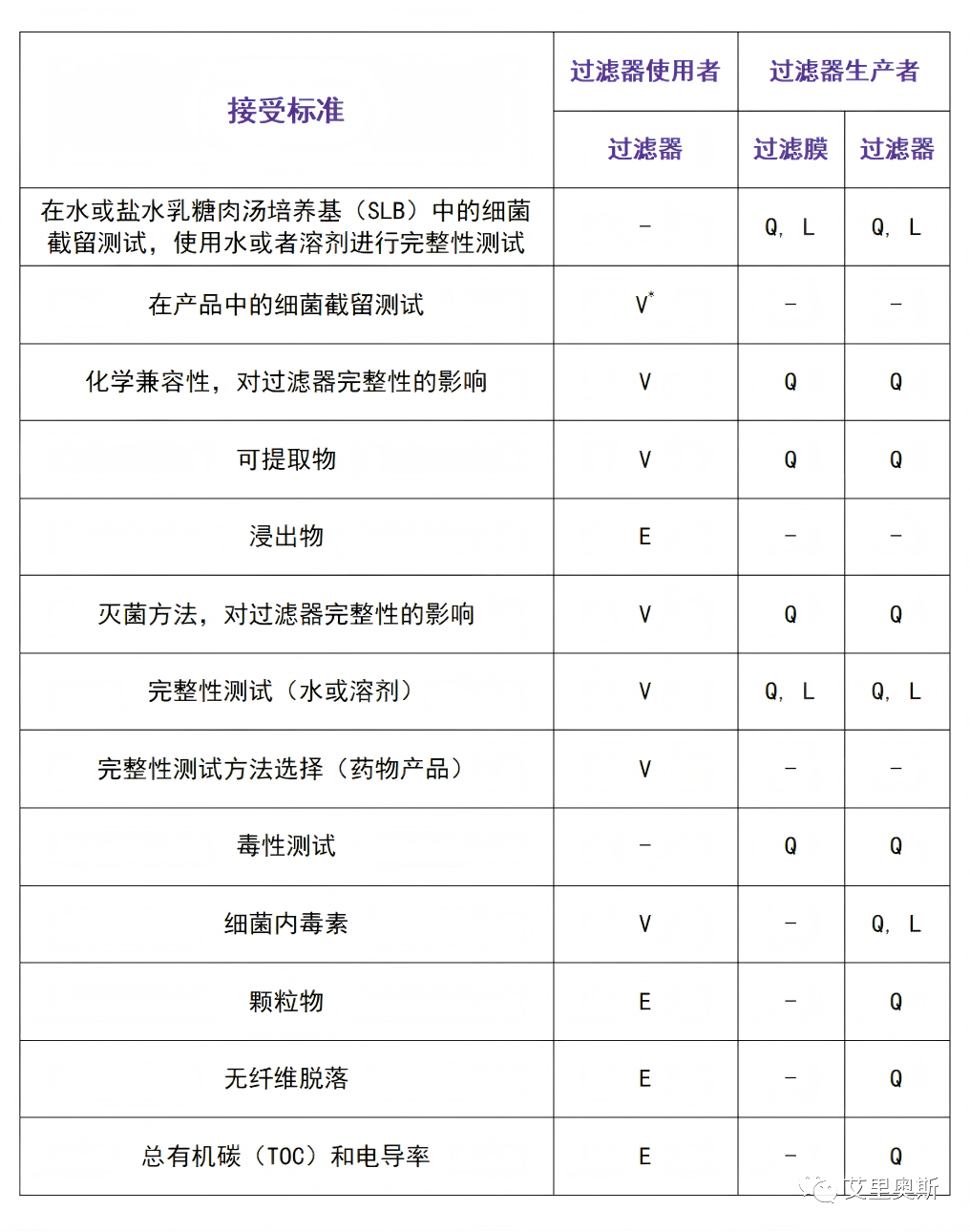
L = 批放行标准
Q = 确认
V = 工艺特定验证
V* = 可使用膜片或者过滤器进行测试
E = 评估是否需要测试
来源:翻译自PDA 26号技术报告
细菌截留测试:生产商在盐水乳糖肉汤、水或者其他适当的液体中进行确认后,过滤器使用者应当在其工艺条件下再次进行确认。因为前者使用了标准溶液标准条件,无法模拟实际的工艺条件。
化学兼容性:生产商可以对过滤器和产品的化学兼容性进行确认,而使用者有必要确认特定操作条件下的工艺流体和过滤器的相容性。通常可通过完整性、流速、外观等方法进行确认。
可提取物:生产商使用模型溶剂和特定的实验条件进行测试,使用者也可根据特定的产品和工艺额外进行确认。
潜在浸出物:通常与特定的产品和工艺条件相关,使用者应当对其进行确认和评估,确保不会对产品造成危害。
安全性测试(如生物反应性):通常由生产商完成,因为其测试的是过滤器材质本身的安全性,与使用工艺条件无关,因此使用者无需进行重复确认。
灭菌:生产商会对过滤器的灭菌耐受能力和灭菌条件进行确认,该条件可能不能代表实际工艺条件,因此使用者应当在特定工艺条件下的灭菌方法进行验证。
颗粒物、无纤维脱落、氧化物、TOC、电导率和流速通常会由生产商进行确认,而使用者应当根据特定工艺条件来评估是否需要进行额外测试。
如果该验证或测试项与特定的工艺条件相关则使用者应当评估或重新验证。
About Us
Products
Application

