Risks and Strategies for Reusing Filters (Part One)
在医药、生物技术和疫苗产业中,过滤器是保障产品安全的关键。随着经济压力和市场竞争的加剧,这些行业正在探索降低成本、提升效率的新途径,其中之一便是考虑重复使用除菌级过滤器。尽管这些过滤器通常被设计为一次性使用,以保证单一批次或生产周期的无菌标准,但实践中,出于成本考量,它们可能会被多次使用。然而,这种做法带来了潜在的风险,对质量控制提出了严峻挑战,因为过滤器的重复使用可能会影响产品的安全性和有效性,甚至可能导致交叉污染。因此,如何在降低成本和保持产品质量之间找到平衡点,是当前工艺优化中的一个重要课题。
液体过滤器的重复使用
上一篇我们谈“减菌过滤”提到液体减菌过滤器的三种重复使用情况:批次间进行冲洗,批次间冲洗和灭菌,批次间清洗、保存和灭菌。实际上可以再细分为以下五种重复使用方式:
- 不需要进行移动、冲洗、清洁、消毒或重新灭菌
- 仅在不同批次之间进行冲洗
- 在不同批次之间既要冲洗也要进行再次灭菌
- 在不同批次之间进行冲洗、清洁以及再次灭菌
- 间歇性使用,并在批次之间进行烘干处理
方式1:无移动、冲洗、清洁、消毒或重新灭菌

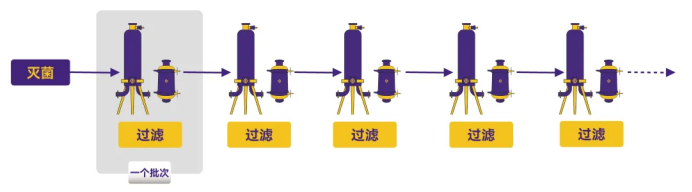
Figure 1. 工艺流程图1
过滤器初次使用前灭菌后保持在原位,批次间无其他操作。
优点:过滤器所受的外力影响(如加热、接触腐蚀性液体等)降至最低。
风险因素:
- 微生物存活:上一批次中可能仍有存活的微生物。
- 滤膜穿透:长时间微生物生长可能导致其穿透滤膜。
- 微生物穿透:长时间使用导致的微生物穿透风险无法仅通过完整性测试来评估。
GMP:根据欧盟和中国2010年版GMP要求,过滤器使用期限不应超过一天。
方式2:仅在批次间冲洗

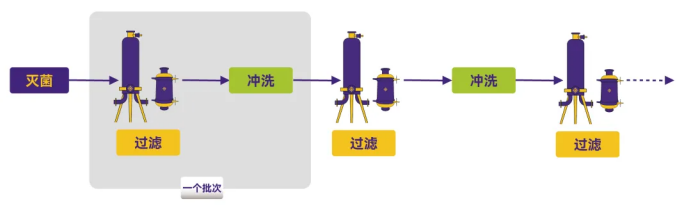
Figure 2. 工艺流程图2
每个生产批次之间,仅通过水或其他溶剂对过滤器进行冲洗,不采取额外措施。
优点:减少工艺溶液中组分的残留,并降低不同批次之间的交叉污染风险。
风险因素:
- 微生物穿透:存在滤膜被长时间生长的微生物穿透的风险
- 内毒素污染:下游溶液可能会受到内毒素的污染
方式3:批次间冲洗和再次灭菌

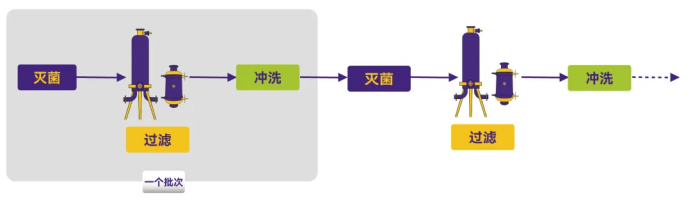
Figure 3. 工艺流程图3
优点:能够减少因长时间使用导致的微生物穿透问题,并有利于控制可能形成的生物膜。
风险因素:
- 不充分冲洗的风险:如果过滤器冲洗不彻底,再灭菌过程中可能会破坏微生物,引起下一批次内毒素水平升高。
- 化学降解的风险:若产品组分残留未被完全冲洗掉,再灭菌过程可能会引发化学降解反应,进而与过滤器发生额外的化学反应。
供应商验证:通常情况下,供应商已对仅经水湿润的完整过滤器进行了验证,证实其能够承受多次高压灭菌或在线蒸汽灭菌。
方式4:批次间冲洗、清洁和再次灭菌

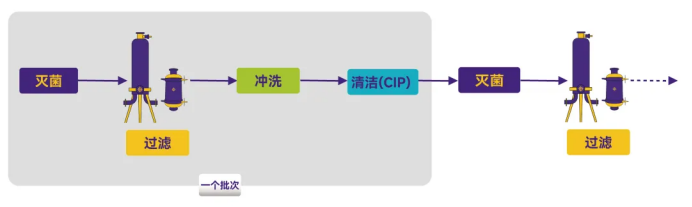
Figure 4. 工艺流程图4
优点:有效减少交叉污染和微生物副产物的风险。
风险因素:
- 完整性测试局限:完整性测试可能无法发现所有潜在的过滤器问题。
- 化学兼容性问题:清洁剂可能与过滤器材料发生不兼容的化学反应。
- 残留物影响:产品组分或清洁剂的残留物在再灭菌过程中可能对过滤器造成更严重的影响。
方式5:间歇使用并批次间烘干

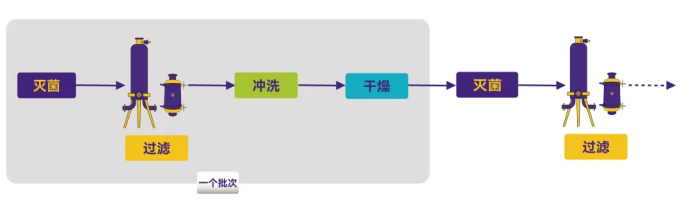
Figure 5. 工艺流程图5
整个过程包括了冲洗、清洁、再次灭菌以及烘干步骤。
风险因素:
- 烘干过程中的浓缩:在烘干阶段,产品组分、清洁剂或其他杂质可能会被浓缩,这可能会加剧化学反应。
以上介绍了不同重复使用方式及其优缺点、潜在风险因素,在各种情况下,为了节约过滤成本,最终用户可能会考虑重复使用过滤器。因此,必须对所有相关工艺和重复使用的条件进行严格验证,确保不会影响过滤器的细菌截留效能和完整性测试的准确性。
液体除菌滤器重复使用的考量
每种应用在生物负荷控制和除菌过滤方面都有特定的要求和风险。除了考虑工艺条件如冲洗、清洁、再灭菌和烘干外,还应根据无菌保障水平和对滤液的影响,单独评估每种应用中过滤器的重复使用适宜性。因此过滤工艺的关键程度也应构成风险评估的一部分,在风险评估的基础上,一些非关键工艺位点可能不需要最高水平的无菌保证。

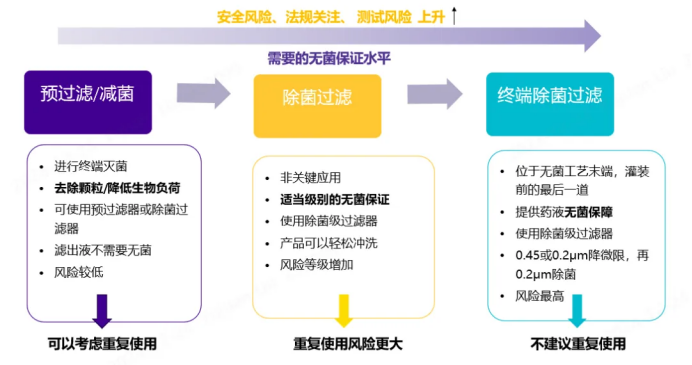
Figure 6. 不同应用要求下重复使用风险程度
对于终端灭菌工艺使用的滤芯
因为它不是用于除菌过滤,只是在前面作为一个降微生物负荷的作用。不建议滤芯用于不同的品种之间交叉使用。
对于这些用于终端灭菌和降低微生物负荷的滤芯,是否可重复使用目前国内外的法规和GMP标准并没有明确禁止这种做法。实际上,在工业实践中确实存在滤芯的重复使用。如果企业决定重复使用滤芯,必须进行相应的研究和验证工作,重点放在清洁验证上。由于滤芯不是用于终端灭菌,因此验证的重点不在于微生物截留能力,而是要基于计划的使用周期和滤芯的清洗情况,特别关注滤芯清洗前后的性能变化。
对于关键应用中重复使用过滤器的策略
在无菌生产工艺中使用的除菌过滤器,我国的GMP以及欧洲的GMP都有相关建议,欧盟GMP建议每处理一个批次后就更换一次过滤器,而我国的GMP规定是在24小时内,即每批生产后更换过滤器。虽然都不建议对用于无菌工艺生产的除菌过滤器进行重复使用,但这并不是绝对的禁止。如果企业坚持重复使用,那么需要进行的工作可能会比较复杂,因此不推荐重复使用。对于那些在注射剂生产前端使用的,用于去除可见异物和不溶性微粒的过滤器,建议可以参考之前提到的终端灭菌过滤器的要求,对这些过滤器的重复使用进行相应的考量和管理。(相关法规指南和行业推荐在下期内容分享)
通常会在生物负荷控制过滤器之后串联使用最终的除菌过滤器,使用双级或冗余除菌级过滤器(0.2或0.1μm)。在这种双级过滤系统中,可以对上游过滤器进行重复使用,而将终过滤器作为一次性使用,以此达到经济与安全的平衡;或者也可以将上一批次的终过滤器重新用作后续批次的上游过滤器。在每种应用案例中,都需要权衡重复使用带来的成本节约与因过滤器过早堵塞、完整性问题、溶出物污染增加或细菌穿透而增加的风险。(见Figure 7)

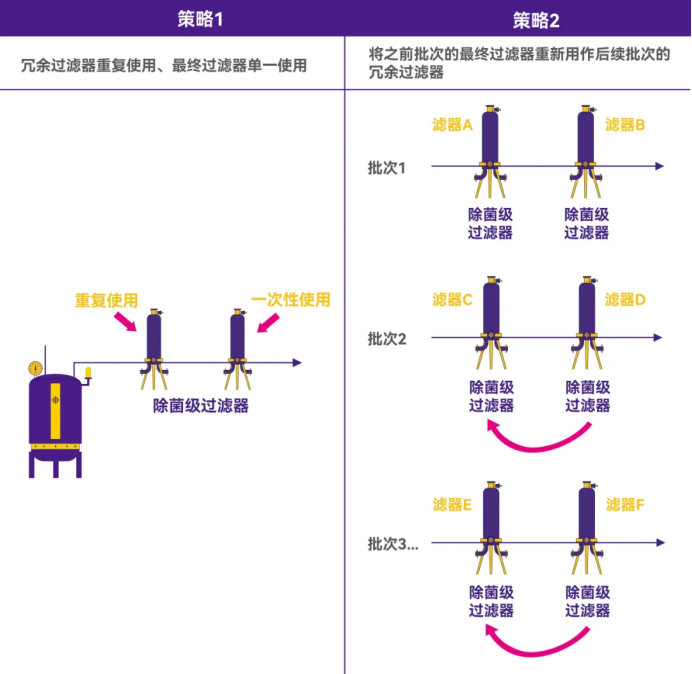
Figure 7.冗余过滤应用中重复使用方式
小结
过滤器的重复使用需严格控制,以保证滤器安全有效,并符合供应商的推荐使用参数。除菌级过滤器的重复使用需包含冲洗、清洁和重新灭菌,且每个环节都需经过设计、构建和验证。使用的水和化学品等级应详细记录,所有化学品和滤出液应依法处理。重复处理过程和过滤器性能检测结果应真实记录。重复使用前,需对滤器进行完整性、无热原、上批产品残留物和副产物的去除测试,并验证其性能和时间限制。验证应考虑pH、粘度、流速、压力、温度等因素,并建立控制方法以确保过滤器不会对后续批次造成污染。尽管存在风险,一些药企在制定了产品和特定工艺的重复使用方案基础上会在实际中重复使用除菌过滤器,具体案例将在后续详细说明。
参考资料
1.J. Martin, "Considerations on Re-Use of Sterilizing-Grade Filters", Pharmaceutical Technology, Sterile Manufacturing, Aseptic Processing (2008).
2.Martha Folmsbee, Ph.D. & Dr. Gabriele Geerligs , Re-Use of Sterilizing Grade Filters -Considerations and Risk Assessments Technical Rationale.
3.US FDA Guidance for Industry: Sterile Drug Products Producced by Aseptic Processing: Good Manufacturing Practice, FDA (2004).
4.EU Guidelines to Good Manufacturing Practice - Medicinal Products for Human and Veterinary Use - Annex 1 -Manufacture of Sterile Medicinal Products (2022).
5.PDA, "Sterilizing Filtration of Liquids," Technical Repdort No. 26, PDA (2008).

